热力学三大定律的学习时机是什么?
熵增原理什么时候学?
熵增原理通常在学习热力学和统计物理学时学习。热力学是物理学的一个分支,研究能量转换和利用等现象。统计物理学则研究用概率论和统计方法处理大量粒子的物理系统。根据学校和课程设置的不同,熵增原理可能会在大学本科阶段的物理学或者工程专业的课程中讲授。当然,如果你对这个概念感兴趣,你也可以自己提前通过阅读相关书籍或在线资源来学习。
什么时候测量热力学温度?
化学反应生成物的温度回到反应物的起始温度时体系所放出或吸收的热量。换句话说,化学反应热通常是指:反应体系在等温、等压过程中发生化学变化时所放出或吸收的热量。
化学反应热按其产生原理可以分为:生成热、燃烧热和中和热三种。化学反应热是重要的热力学数据。在一个化学反应中,反应物的总能量大于生成物的总能量,则称该反应是放热反应,△H<0,反之则为吸热反应,△H>0。
物质的燃烧热是指,气压101kP时1mol纯物质完全燃烧生成稳定氧化物时所释放的热量。中和热是指,强酸与强碱发生中和反应生成1molH2O时所放出的热量。反应热的理论计算公式如下:
式中:U是热力学能;p 是压强;H是焓;n是物质的量;T是绝对温度;R表示气体常数
热力学温度,又叫热力学标温,符号T,单位K(开尔文,简称开)。 早在1787年法国物理学家查理(J.Charles)就发现,在压力一定时,温度每升高1℃,一定量气体的体积的增加值(膨胀率)是一个定值,体积膨胀率与温度呈线性关系。国际实用温标是以国际上所通过的一系列纯物质的固定点(如平衡氢三相点、平衡氢沸点、氧三相点、水三相点、锡凝固点等)作为基准用于标定规定的基准温度计(如铂电阻温度计和铂-10%铑/铂热电偶等)并给出相应的内插公式用于测定温度。
低温下超导体产生的磁浮现象物体的温度实际上就是原子在物体内部的运动。当我们感到一个物体比较热的时候,就意味着它的原子在快速运动:当我们感到一个物体比较冷的时候,则意味着其内部的原子运动速度较慢。我们的身体是通过热或冷来感觉这种运动的,而物理学家则是绝对温标或称开尔文温标来测量温度的。
按照这种温标测量温度,绝对温度零度(0K)相当于摄氏零下273.15度(-273.15℃)被称为“绝对零度”,是自然界中可能的最低温度。在绝对零度下,原子的运动完全停止了,那么就意味着我们能够精确地测量出粒子的速度(0)。然而1890年德国物理学家马克斯·普朗克引入的了普朗克常数表明这样一个事实:粒子的速度的不确定性、位置的不确定性与质量的乘积一定不能小于普朗克常数,这是我们生活着的宇宙所具有的一个基本物理定律。(海森堡不确定关系)那么当粒子处于绝对零度之下,运动速度为零时,与这个定律相悖,因而我们可以在理论上得出结论,绝对零度是不可以达到的。
熵增定律什么时候学?
熵增定律在高中时学的。
物理定义:熵增过程是一个自发的由有序向无序发展的过程(Bortz, 1986; Roth, 1993)。 热力学定义:熵增加,系统的总能量不变,但其中可用部分减少。统计学定义:熵衡量系统的无序性。熵越高的系统就越难精确描述其微观状态。
热力学第三定律是在什么背景下提出的?
热力学第三定律是热力学的四条基本定律之一,其描述的是热力学系统的熵在温度趋近于绝对零度时趋于定值。而对于完整晶体,这个定值为零。由于这个定律是由瓦尔特·能斯特归纳得出后进行表述,因此又常被称为能斯特定理或能斯特假定。1923年,吉尔伯特·路易斯和梅尔·兰德尔对此一定律重新提出另一种表述。
是否存在降低温度的极限?1702年,法国物理学家阿蒙顿已经提到了“绝对零度”的概念。他从空气受热时体积和压强都随温度的增加而增加设想在某个温度下空气的压力将等于零。根据他的计算,这个温度即后来提出的摄氏温标约为-239°C,后来,兰伯特更精确地重复了阿蒙顿实验,计算出这个温度为-270.3°C。他说,在这个“绝对的冷”的情况下,空气将紧密地挤在一起。他们的这个看法没有得到人们的重视。直到盖-吕萨克定律提出之后,存在绝对零度的思想才得到物理学界的普遍承认。[2]

1848年,英国物理学家汤姆逊在确立热力温标时,重新提出了绝对零度是温度的下限。
1906年,德国物理学家能斯特在研究低温条件下物质的变化时,把热力学的原理应用到低温现象和化学反应过程中,发现了一个新的规律,这个规律被表述为:“当绝对温度趋于零时,凝聚系(固体和液体)的熵(即热量除以温度的商)在等温过程中的改变趋于零。”
德国著名物理学家普朗克把这一定律改述为:“当绝对温度趋于零时,固体和液体的熵也趋于零。”这就消除了熵常数取值的任意性。1912年,能斯特又将这一规律表述为绝对零度不可能达到原理:“不可能使一个物体冷却到绝
热学三大定律是谁?
热力学三大定律分别是:
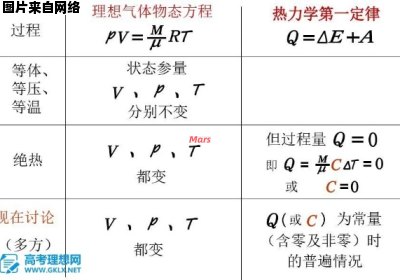
1、热力学第一定律:热量可以从一个物体传递到另一个物体,也可以与机械能或其他能量互相转换,但是在转换过程中,能量的总值保持不变。
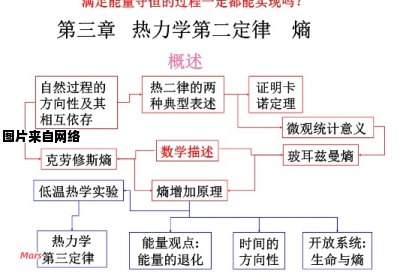
2、热力学第二定律:不可能把热从低温物体传到高温物体而不产生其他影响,或不可能从单一热源取热使之完全转换为有用的功而不产生其他影响,或不可逆热力过程中熵的微增量总是大于零。
3、热力学第三定律:热力学系统的熵在温度趋近于绝对零度时趋于定值。
这一定律由瓦尔特·能斯特归纳得出,并提出其表述,因而又常被称为能斯特定理或能斯特假定。
热力学第三定律,
一般当封闭系统达到稳定平衡时,熵应该为最大值,在任何自发过程中,熵总是增加,在绝热可逆过程中,熵增等于零。 在绝对零度,任何完美晶体的熵为零。
热力学第一定律是能量守恒定律。
热力学第二定律有几种表述方式:克劳修斯表述为热量可以自发地从温度高的物体传递到温度低的物体,但不可能自发地从温度低的物体传递到温度高的物体;
开尔文普朗克表述为不可能从单一热源吸取热量,并将这热量完全变为功,而不产生其他影响。以及熵增表述:孤立系统的熵永不减小。
热力学第三定律通常表述为绝对零度时,所有纯物质的完美晶体的熵值为零,或者绝对零度(T=0K)不可达到。
扩展资料:
1824年,法国工程师萨迪·卡诺提出了卡诺定理。德国人克劳修斯(Rudolph Clausius)和英国人开尔文(Lord Kelvin)在热力学第一定律建立以后重新审查了卡诺定理,意识到卡诺定理必须依据一个新的定理,即热力学第二定律。
他们分别于1850年和1851年提出了克劳修斯表述和开尔文表述。这两种表述在理念上是等价的。违背热力学第二定律的永动机称为第二类永动机。
热力学第一定律:能量守恒定律由此克劳修斯最后得出热力学第一定律的解析式
热力学第二定律:熵增定律由此克劳修斯提出了热力学第二定律的又一个表述方式,也被称为熵增原理
热力学第三定律:绝对零度的探索德国著名物理学家普朗克把这一定律改述为:“当绝对温度趋于零时,固体和液体的熵也趋于零。”这就消除了熵常数取值的任意性。1912年,能斯特又将这一规律表述为绝对零度不可能达到原理:“不可能使一个物体冷却到绝对温度的零度。”这就是热力学第三定律。
上一篇:如何预知黄鼠狼的出现?
下一篇:为何目前无法复课?
