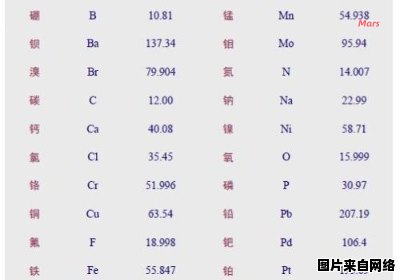
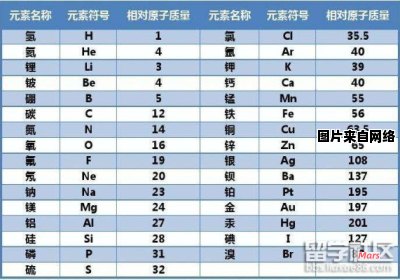
原子质量的相对表达式
质量分数表达式?
液体的质量分数为溶液中溶质质量与溶液质量*100%,其中溶液质量为溶质质量+溶剂质量,固体的质量分数为所求物质的质量/总的物质的质量*100% 质量分数是指溶质质量与溶液质量的百分比,质量分数也可以指化合物中各原子相对原子质量与总式量的比值,即某元素在某物质中所占比例。
oh根的相对分子质量?
氢氧根离子(OH-)的相对分子质量为17;其中氧原子的相对原子质量是Ar(O)=16;氢原子的相对原子质量是Ar(H)=1;相对分子质量(Mr)等于化学式中各个原子的相对原子质量(Ar)的总和,用数学表达式可以写为:Mr(OH-)=Ar(O)+Ar(H)=16+1=17;
氢氧根离子(OH-)是由氧原子和氢原子通过一对共用电子对形成的带有一个单位负电荷的阴离子。能与很多金属阳离子形成氢氧化物,例如氢氧化钠NaOH,氢氧化钙Ca(OH)2,氢氧化铝Al(OH)3等。
相同质量的co和co2原子个数比?
21:22
假设均为1g,则CO2的物质的量为:n=1/44mol,原子数为:N=(1/44)x3mol;CO的物质的量为:n=1/28mol,原子数为:N=(1/28)x2mol,N(CO2)/N(CO)=21/22
CO(一氧化碳)和CO₂(二氧化碳)是两种不同的化合物,它们分别由碳(C)和氧(O)组成。为了找出相同质量的CO和CO₂的原子个数比,我们需要使用它们的相对分子质量和元素的相对原子质量。
1. **一氧化碳(CO):**
- 碳的相对原子质量(相对分子质量的一半)为 12.01。
- 氧的相对原子质量为 16.00。
- CO的相对分子质量为 \(12.01 + 16.00 = 28.01\)。
2. **二氧化碳(CO₂):**
- 碳的相对原子质量为 12.01。
- 氧的相对原子质量为 16.00。
- CO₂的相对分子质量为 \(12.01 + 2 \times 16.00 = 44.01\)。
现在,如果我们想比较相同质量的CO和CO₂的原子个数比,我们可以使用它们的相对分子质量。
假设我们比较的是相同质量的1克CO和1克CO₂:
- **CO中碳的原子个数:** \(\frac{1 \text{ g CO}}{28.01 \text{ g/mol CO}} \times 6.022 \times 10^{23} \text{ atoms/mol}\)
- **CO₂中碳的原子个数:** \(\frac{1 \text{ g CO₂}}{44.01 \text{ g/mol CO₂}} \times 6.022 \times 10^{23} \text{ atoms/mol}\)
计算这两个表达式,你将得到相同质量的CO和CO₂的碳原子个数比。
上一篇:高中数学教材的章节与内容
下一篇:粉虱有哪些不同类型存在?
