催化剂促进化学反应速度的机制是什么
催化剂的反应机理?
1. 是已知的。
2. 催化剂通过提供一个能量更低的反应路径,降低了反应的活化能,从而加速了化学反应的进行。
催化剂通常通过吸附反应物分子,使其发生化学反应,并在反应结束后再次释放出产物分子。
这种吸附-解吸的过程可以降低反应的能垒,从而加速反应速率。
3. 还涉及到催化剂与反应物之间的化学键的形成和断裂,以及催化剂表面的活性位点对反应物的选择性吸附等。
此外,催化剂的选择和设计也是一个重要的研究方向,可以通过调控催化剂的结构和成分来优化反应机理,提高催化剂的活性和选择性。
催化剂加速化学反应是通过改变化学反应什么,降低反应?
所谓“催化剂”,指的是在化学反应中能够改变反应速率——有的可以加速反应,有的则是减缓反应,但是在反应前后物质的量以及物质的化学性质却没有发⽣改变的物质。也就是说,在化学反应中加⼊催化剂,看起来似乎催化剂没有参加反应,毕竟反应前后它是“⼀点变化”也没有啊。但这样的理解是错误的。
实际上有的催化剂不参加反应,但是有的催化剂是参与了化学反应的,只不过它既是反应物,也是⽣成物,⽽且反应的量和⽣成的量相等,因此才会造成⼤家对它的误会。
催化剂改变化学反应的速率的⽅式有很多,不同的催化剂在不同的反应中效果都不⼀样。在这⾥我们就简单说⼀点最普遍的⽅式,那就是催化剂的存在降低(或升⾼)了反应的活化能,从⽽增加(或减少)了活化分⼦数,因此加快(或降低)了化学反应的速率。
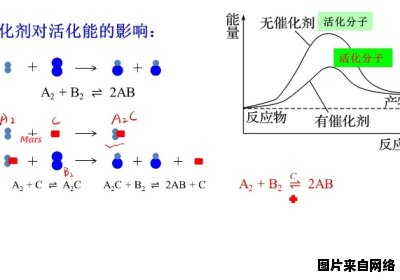
在这⾥我们提到了“反应活化能”、“活化分⼦”等⽐较专业的词汇,实际上我们也可以从通俗的⾓度来理解催化剂的机制:⾸先考虑⼀个化学反应,⽐⽅说A物质与B物质发⽣化学反应,实际上是许多A分⼦与许多B分⼦的相互作⽤过程。
这就好⽐⼀堆男⽣和⼀堆⼥⽣在公园⾥举⾏相亲⼤会,具备⾼、富、帅三个条件的男⽣(活化的A分⼦)就先约到了那些具备⽩、富、美的⼥⽣(活化的B分⼦),这就相当于发⽣了反应。
由于同时具备⾼富帅的男⽣和同时具备⽩富美的⼥⽣都很少,所以反应速度很慢。当我们加⼊催化剂,就算是降低了⼤家的择偶条件,男⽣只要具备帅,就可以算是“活化的A分⼦”;⼥⽣只要具备美,就可以算是“活化的B分⼦”——这样⼀来,⼤家配对的⼏率⼤⼤提⾼,反应也⼤⼤加快了。
催化剂一定加快化学反应速率吗?
不一定
催化剂是指在化学反应中能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后不变的物质;有的催化剂能加快反应速度,有的催化剂能减慢反应速度,一定能改变反应速率.
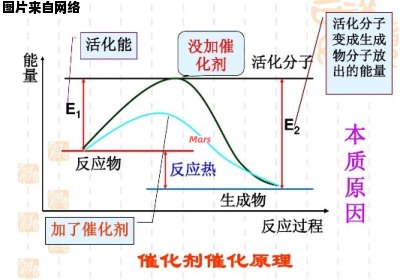
催化剂在化学反应中的作用是提高反应的活化能。?
催化剂只能加速热力学上可以进行的反应。要求开发新的化学反应催化剂时,首先要对反应进行热力学分析,看它是否是热力学上可行的反应。
催化剂只能加速反应趋于平衡,不能改变反应的平衡位置(平衡常数)。
催化剂对反应具有选择性,当反应可能有一个以上不同方向时,催化剂仅加速其中一种,促进反应速率和选择性是统一的。
催化剂的寿命。催化剂能改变化学反应速率,在理想情况下催化剂不为反应所改变。
上一篇:千针石林的探险挑战
下一篇:河海大学常州分校的一些教材
